|
||||
|
|
핫이슈 |
|||||||||||
|
동 구리 역사 swwet | 2020.04.15 | 조회 2,359 | 추천 1 댓글 2 |
|||||||||||
마지막 구리 동에 대해서도 알아봅니다.구리(Cu)전기와 열이 잘 통하는 금속 [ Copper[Cuprum] ]
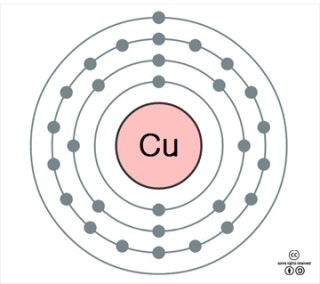
구리(copper) 1)는 원자번호 29번의 원소로, 원소기호는 Cu이다. 주기율표에서 은(Ag), 금(Au)과 함께 11족(1B족)에 속하는 전이금속이다. 이들 세 금속은 예부터 화폐 제조에 사용되었기 때문에 ‘화폐 금속(coinage metal)’이라 부르며, 모두 천연 상태에서 원소 상태로 발견된다(은과 구리는 화합물 형태로도 채굴된다). 이들 금속은 아주 좋은 전기 및 열 전도체이고 비교적 무르며, 가는 선으로 늘릴 수 있는 성질(연성)과 두드려 얇게 펼 수 있는 성질(전성)이 아주 크다. 화폐 금속 중에서는 구리가 가장 값싸게 많은 양이 생산되기 때문에 실용적인 목적으로 가장 많이 사용된다. 구리는 화학 반응성이 제법 큰 편으로, 건조한 공기에서는 거의 산화되지 않으나 습한 공기 중에서는 푸른색 녹이 슨다. 그러나 구리 녹이 내부를 보호하므로, 내부까지 부식되지는 않는다. 진한 황산, 질산 등의 산화성 산에 녹으며, 비산화성 산에는 공기나 산화제가 있으면 녹는다. 구리는 화합물에서 주로 산화수가 +1이나 +2인 상태로 있다. 금속 구리는 적갈색인 반면, +2 상태의 이온이나 화합물은 푸른색 또는 녹색을 띤다. 구리는 원소 또는 화합물 상태로 발견되는데, 1857년에 미국 미시간 주에서는 무려 420톤의 원소 상태 구리가 발견되었다. 구리 야금법이 발견되기 전까지는 천연 구리 금속을 사용하였는데 이제는 더 이상 천연 구리를 찾기가 어렵고, 따라서 지금 사용하는 구리는 거의 모두가 구리 광석에서 제련해서 얻거나 이전에 이미 사용한 것을 재활용하는 것이다. 구리의 지각에서의 존재 비는 약 70 ppm(0.007%)으로, 대략 25번째로 풍부한 원소이다. 구리 광물들이 여럿 있는데, 이들은 황(黃)동석(chalcopyrite, CuFeS2), 휘(輝)동석(chalcocite, Cu2S), 남(濫)동석(azurite, Cu3(OH)2(CO3)2), 공작석(Cu2(OH)2CO3), 적동석(cuprite, Cu2O) 등이며, 이중 황동석이 전체 구리 광석 매장량의 약 50%를 차지한다. 구리는 철, 알루미늄 다음으로 많이 재활용되는 금속으로, 미국의 경우에는 사용되는 구리의 약 반이 재생 구리이다. 구리는 고대부터 금속 자체로 또는 다른 금속과 합금을 만들어 조각품, 전쟁 무기, 건축 구조물, 각종 생활 도구 등을 만드는 데 사용되었으며, 지금도 일상 생활과 관련된 여러 제품에 널리 사용된다. 구리의 약 60%는 전선에 사용되며, 송수관, 지붕, 자동차 라디에이터 등 기계 장치의 부품, 열 교환기, 주방 기구, 주화, 장신구 등을 만드는 데 널리 사용된다. 또한 구리와 구리 화합물들은 항균 작용이 있으며, 표면에 생물들이들러붙어 번식하는 것을 막는다. 이 때문에 배의 밑 바닥 처리와 살균제로도 사용된다. 구리는 대체로 인체 독성이 없으며, 고등식물과 동물에게 필수적인 영양소로 여러 가지 효소의 생산과 활성에 관여하고, 공기 호흡에도 관여한다. 따라서 구리가 결핍되면 여러 신체 이상을 일으킬 수 있다. 갑각류, 연체동물, 일부 절지 동물들의 혈액은 산소 운반체로 철이 들어있는 헤모글로빈(hemoglobin) 대신에 구리가 들어있는 헤모시아닌(혈청소, hemocyanin)을 포함하고 있어 푸른색을 띤다. 인류는 처음에는 원소 형태로 존재하는 구리를 채집하고 이를 가공하여 사용하였다. 구리는 적갈색을 띠며 또 비교적 큰 덩어리로 존재하기 때문에 금이나 은보다 많은 양을 쉽게 채집할 수 있었을 것이다. 기원전 9000년경에 만들어진 구리 구슬이 북부 이라크에서 발견된 것으로 보아, 인류가 구리를 처음 사용한 것은 최소한 약 1만년 전쯤일 것으로 여겨진다. 기원전 7500년경에 불에 구운 구리 광석을 숯과 함께 가열하면 구리가 얻어진다는 것이 중동에서 발견되었고, 중국에서는 이와 같은 구리 야금법이 기원전 약 2,800년경에 터득되었다고 여겨진다. 역사학자들은 청동기가 만들어지기 전에 천연 또는 야금된 구리를 가공하여 사용한 시대를 ‘구리 시대(copper age)’라 한다. 구리보다 단단한 청동은 구리와 주석(Sn)의 합금으로 기원전 4000년~3000년경에 현재의 이란 지역에 살았던 수메르인들이 처음 만들었고, 이를 이용하여 여러 도구를 만드는 청동기 시대가 시작되었다. 청동기 시대는 남 유럽에서는 기원전 3700~3300년경에, 북 유럽에서는 기원전 2500년경에, 중국에서는 기원전 3000년경에, 그리고 한반도에서는 기원전 2000~1500년경에 시작되었다고 여겨진다. 청동을 만들기 위해서는 구리 광석과 주석 광석이 모두 필요한데, 이들이 같은 지역에서 나오는 경우는 거의 없어, 이들(특히 주석 광석)을 얻는 것이 고대 무역에서 아주 중요한 부분이 되었다. 구리와 이의 합금들은 화폐, 조각상, 건축 구조물, 주방기구, 장식품 등에 사용되었다. 중세 이후에는 구리가 배의 선체를 씌우는 데 많이 사용되었는데, 미 대륙을 발견한 콜럼버스의 함대도 이런 유형의 배들로 구성되었다. 1830년에는 구리의 분말 야금법이 발견되었고, 1876년에는 현대식 구리 전기도금 공장이 가동을 시작하였다. 전기를 생산하는 방법이 발명되고 전기가 여러 곳에 공급되면서, 전선에 사용되는 구리 수요가 크게 늘게 되었다. 고대 로마인들은 구리를 주로 키프로스(Cyprus) 섬에서 채굴하였다. 이 때문에 구리를 ‘키프로스의 금속’이라는 뜻의 ‘키프륨(cyprium)’으로 불렀는데, 뒤에는 줄여서 ‘cuprum’이 되었다. 라틴어 cuprum은 게르만어에서는 ‘kupar’로, 고대 영어에서는 ‘coper’로 되었다가 지금은 영어로는 ‘copper’, 독일어로는 ‘kupfer’가 되었다. 구리는 적갈색을 띠는 금속으로 회색이나 은색 이외의 색을 띠는 3가지 금속 중의 하나인데, 나머지 2가지는 오스뮴(Os, 푸른색)과 금(Au, 노란색)이다. 무르고, 연성과 전성이 아주 크며, 순수한 금속 중에서는 은(Ag) 다음으로 열과 전기를 잘 통한다. 녹는점은 1084.62oC이고, 끓는점은 2562oC이며, 20oC에서의 밀도는 8.94g/cm3이다. 결정은 면심입방구조(fcc)를 가지며, 반자기성(diamagnetic)으로 자석에 끌리지 않는다. 천연 상태의 동위원소는 63Cu(69.15%)와 65Cu(30.85%) 두 가지로, 이들은 모두 안정하다. 여러 가지 인공 방사성 동위원소들이 합성되었는데, 가장 반감기가 긴 것이 67Cu(반감기 61.83 시간)이고, 그 다음으로 긴 것이 64Cu(반감기 12.7 시간)이다. 질량수가 64 보다 큰 것은 β- 붕괴를 하고 아연(30Zn)이 되며, 64보다 작은 것은 β+ 붕괴를 하고 니켈(28Ni)이 된다. 64Cu는 β- 붕괴와 β+ 붕괴를 모두 한다. 64Cu는 x-선 영상 촬영에서 조영제로 사용되며, 이의 착물은 암의 방사성 치료에 이용되고, 윌슨병(Wilson’s disease) 등의 연구에서 방사성 추적자로도 사용된다. 62Cu(반감기 9.67 분)는 양성자 단층 촬영(PET)에서 방사성 추적자로 사용된다. 구리 원자는 29개의 전자를 갖고 있어, 바닥 상태 전자 배치는 [Ar]3d104s1 이다. 구리의 색깔은 채워진 3d 오비탈에 있는 전자가 반 채워진 4s 오비탈로 전이될 때 흡수하는 빛 때문에 나타난다. 폴링의 전기 음성도는 1.90로, 비교적 전기 양성도가 작은 금속이다. 화합물에서는 주로 +1과 +2의 산화상태를 가지며, Cu+/Cu, Cu2+/Cu 반쪽 전지의 표준 전극 전위는 각각 0.521 V, 0.339 V이다. Cu2+ + 2e- → Cu Eo = 0.339 V 구리는 순수한 물과는 반응하지 않으나, 염분이 있는 물에는 느리게 녹는다. 실온의 건조한 공기 중에서는 산화되지 않으나, 가열하면 산화되어 주로 Cu2O가 된다. 습한 공기 중에서는 습기와 이산화탄소(CO2)의 작용으로 천천히 푸른색 녹(녹청, CuCO3·Cu(OH)2)이 스는데, 이 녹의 조직이 치밀하여 내부를 보호하므로 부식은 더 이상 진행되지 않는다. 구리는 황화 수소(H2S), 황, 황화물, 할로겐 원소 등과 반응하나, 산화제(산소 포함)가 없으면 비산화성 산과는 거의 반응하지 않는다. 그러나 뜨거운 진한 황산(H2SO4)에는 녹고, 질산(HNO3)의 경우에는 묽은 질산과 진한 질산 모두에 녹는다. 산소가 녹아 들어간 염산(HCl), 암모니아(NH3) 용액에도 녹는다. Cu2+는 배위 착화합물을 잘 만드는데, 물에서는 푸른색의 Cu(H2O)6 2+로 존재한다. Cu2+ 수용액에 염기를 가하면 연한 푸른색의 Cu(OH)2 가 침전되며, 암모니아(NH3)를 가하면 처음에는 Cu(OH)2가 침전되나, 과량으로 가하면 [Cu(NH3)4(H2O)2]2+ 착이온이 되면서 녹는다. 구리 산화물 광석에서 구리 금속을 얻기 위해서는 광석을 코크스와 함께 가열하여 환원시키면 된다. 그러나 현재 생산되는 구리는 주로 황(黃)동석(chalcopyrite, CuFeS2)에서 얻으며, 일부는 휘(輝)동석(chalcocite, Cu2S)에서 얻는다. 광산에서 채굴되는 이들 황화물 광석의 구리 함량은 대략 0.5%에 불과하기 때문에 먼저 광석을 곱게 부순 후 광석 가루를 물과 섞고 밀도 차이를 이용한 부유 선광법으로 구리 함량을 10~20%로 농축시킨다. 구리 제련 방법 농축된 구리 광석을 실리카(SiO2)와 섞고 반사로에서 약 1400oC로 가열하면 황화철(FeS)이 Cu2S보다 먼저 산화된 다음 실리카와 반응하여 슬래그(slag)가 되는데, 이 슬래그가 주성분 Cu2S와 약간의 FeS로 구성된 액체 구리 마트(matte) 층 위에 뜨게 된다. 슬래그를 제거한 후 남아있는 액체 구리 마트에 실리카를 다시 첨가한 후 이를 전로에 넣고 공기를 불어넣으면 FeS는 슬래그가 되고, Cu2S는 산화제1구리(Cu2O)로 전환된다. Cu2O를 가열하면 순도 약 98%의 구리인 조동(粗銅, blister copper)이 얻어진다. 2Cu2S + 3O2 → 2Cu2O + 2SO2 2Cu2O → 4Cu + O2 (또는 2Cu2O + Cu2S → 6Cu + SO2)
음극 반응: Cu2+(aq) + 2e- → Cu(s)
구리의 재활용, 광석 매장량 및 생산량 인류가 구리를 사용한 지는 1만년이 넘지만, 본격적으로 많은 양의 구리가 생산되기 |
|||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
 |
|||||||||||